医疗器械合约制造厂低成本合规修炼之PLM
一、医疗器械注册人制度的现况
2019年2月22日,国务院发布《国务院关于全面推进北京市服务业扩大开放综合试点工作方案的批复》(简称“北京市综合试点批复”),同意北京市“开展医疗器械注册人制度试点,允许北京市医疗器械注册人委托京津冀地区医疗器械生产企业生产医疗器械。”继上海、广东、天津之后,北京成为第四个加入医疗器械注册人制度试点范围的城市。在药品领域,药品上市许可持有人试点已经开展三年。前不久,为了做好药品上市许可持有人制度试点工作和《药品管理法》修改工作的衔接,2018年10月26日第十三届全国人大常委会第六次会议决定,将此前授权国务院在部分地方开展的“三年期”药品上市许可持有人制度试点工作延长一年,有效期至2019年11月4日。
从实践和立法层面,我国药品和医疗器械的上市许可持有人制度正在积极、稳步地向前推行,一旦人大常委会通过相关立法修订就可由区域试点推行到全国。
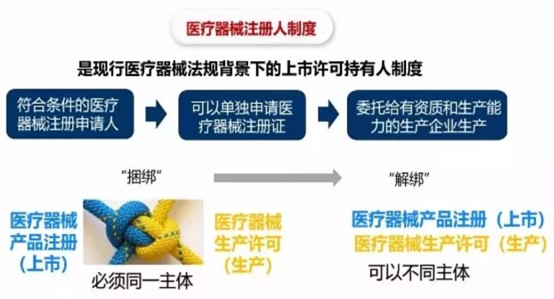
医疗器械MAH制度的目标,一是要构建一个贯穿医疗器械产品全生命周期的责任主体,使其承担对产品质量自始至终的管理义务;二是让医疗器械MAH成为疏通产品注册与生产管理壁垒的主体,破除产品上市许可和生产许可的捆绑关系;三是通过医疗器械MAH制度的实施,实现行业资源合理配置,刺激行业研发投入增加,达到推动行业创新发展的目的。
医疗器械MAH制度的关键内容主要有:其一,允许研发机构或者科研人员作为注册申请人,提交临床试验申请和上市申请。取得医疗器械注册证的申请人,转变为医疗器械注册人,也就是医疗器械MAH。其二,医疗器械MAH具备相应生产资质的,既可自行生产,也可委托生产。持有人不具备生产条件的,可以直接委托具备资质的生产企业生产医疗器械。其三,在医疗器械委托生产中,不具备生产资质的受托方可以凭委托方的注册证办理生产许可。其四,允许委托多个受托方生产。从内容上看,医疗器械MAH制度的内涵与药品MAH制度是一致的,是MAH制度在药品和医疗器械两个不同行业的应用,直接目标就是要打破医疗器械注册与生产管理的捆绑关系。
医疗器械MAH制度实施前,上市许可(医疗器械注册证)一般只颁发给具有医疗器械生产资质的企业,医疗器械研发机构及其科研人员都没有独立获得上市许可的机会。这与药品MAH制度实施前的情形极其相似。在医疗器械委托生产时,只有一家医疗器械生产企业能够成为受托人。也就是说,医疗器械从产品注册到委托生产这一过程中,注册与生产是深度捆绑的。捆绑导致了行业资源流动受限和社会生产分工受阻,最终妨碍行业的健康发展。制度实施后,相关研发机构、企业甚至是科研人员被纳入注册申请人的范畴,医疗器械MAH成为产品全程质量管理的责任主体。再加上医疗器械委托生产管理制度的变革,注册许可和生产许可的捆绑关系将不复存在,行业资源配置以及产业研发创新水平也将在制度实施后得到改善。正所谓,“实施MAH制度后,MAH主体范围放宽,生产企业可委托已具备生产条件的企业进行生产,进而实现双赢”,最终可实现社会资源的合理配置和行业生产的自由分工。

二、医疗器械上市许可持有人制度带来的机会
医疗器械行业使用委外制造业务的增长,其主要表现:
1、过去医疗器械生产许可与工厂能力互相绑定, 但未来医疗器械生产与授权分离后, 过去专职生产企业获得更多来自医疗设备公司的机会,在2001年时 , 国外统计估计显示:
25%的医疗设备公司正在外包
到2006年增长到62%, 而增长的部分将委托给拥有医疗器械生产许可的外包厂
2、过去拥有丰富代工经验的电子代工厂会投入到器械合约生产行业
在2001年,国外电子代工厂来自医疗设备营业约占OEM的30%
到了到2003年这一数字将长到44
3、对合约制造商的需求会大量增加: 过去医疗设备厂商受限自身的生产规模能力, 未来专业器械
生产厂商能大量有效扩大生产能力
对于合规/变更/设计需求的大量增加
医疗注册申请人的监管负担仍然很大,但是系统维护和文档控制被推到了医疗器械生产厂商
三、PLM在许可持有人制度与生产许可分离管理中提供核心价值
因为制造能力的大量提升, 加上专业代工厂的研发能力与质量能力大量提高, 会大量加速产品进入市场 : time to market加速NPI 达 60 %
能较竞争对手快20%交付新产品或新功能
加速问题处理速度达 80 %
比过去更快的进入大量生产, 相较过去, 医疗设备所产生收益的时间会大量提早 : time to profit
合规速度增加50 %
废料成本降低25-50%
原物料成本降低3-5%
降低达成合规的成本与风险
减少提交文件准备时间的75%
四、Teamcenter如何交付PLM在医疗器械行业的价值
Teamcenter DHF 精灵
Teamcenter 所体现的价值 :
1、运营成果与业务价值的映射
迅速平稳的加速量产
变更整合周期时间缩短300%
支持虚拟制造和简化的IP传输
2、以OEM方式应对市场挑战
符合对外部承诺的市场交付日期
加速满足大量生产
3、由于在 Teamcneter 平台上建立了全面的服务功能,EMS赢得了业务;通过OEM继续发展业务
4、医疗器械分级合规产出管理模板
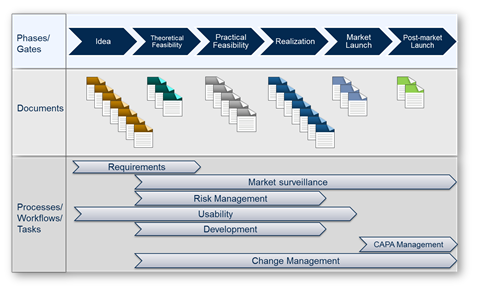
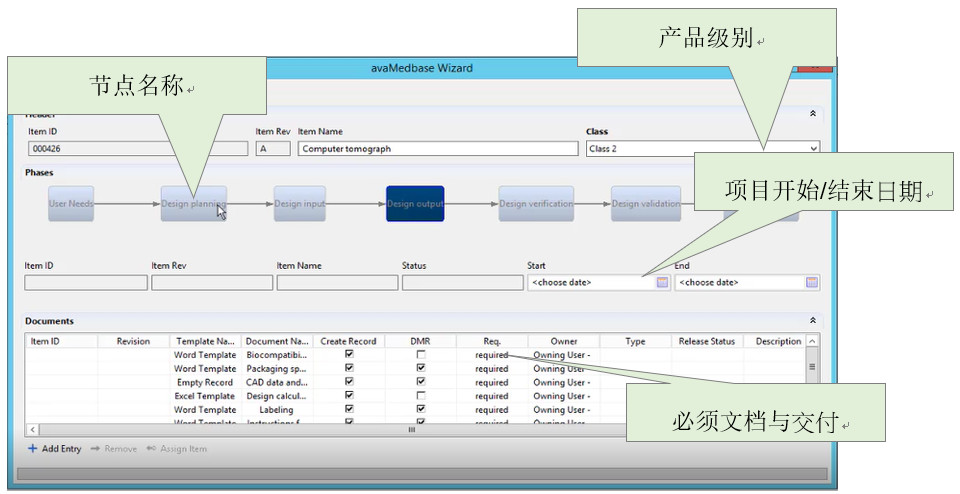
在大多数公司中,不仅有一个产品开发过程,而且有多个不同的过程,例如针对不同的产品组。因此,在DHF向导中,我可以配置不同的“结构类”,其中包含不同的流程,文档和工作流. 这使用户可以遵循系统领导的质量管理流程,而不必学习质量管理手册.
5、医疗器械分级合规产出管理模板
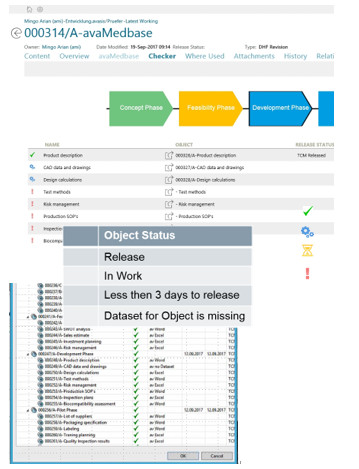
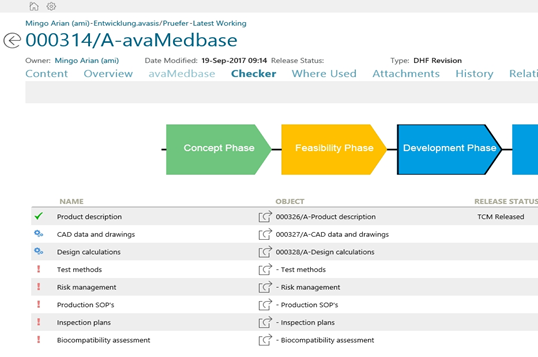
使用Teamcenter 的DHF检查器,可以随时检查Design History文件的完整性。以配置阶段的颜色,并指示阶段是否已释放或正在进行中, 图标显示对象或文档的状态。
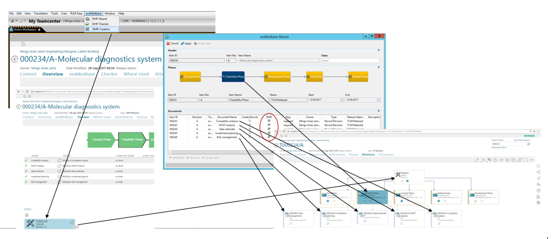
在DHF中发布所有阶段和批准文件后,即可创建DMR。在向导中定义了哪些元素必须在DMR中可用。所有这些元素在指定的结构中都引用到一个单独的储存位置中。
五、结论
透过 PLM 旨在建立一个强大的数字化产品开发协作环境和可重用企业知识库, 而在医疗器械行业中, 除了传统的规范和优化器件与BOM管理, 实现产品开发文件的统一安全规范项目管理流程、IPD可视化, 加强产品架构配置管理,方便产品变型设计规范管理软件、硬件测试中的流程与数据外, 更能实现对新产品开发项目的全过程管理, 达到合规需求:
实现对个人工作的全面管理;
实现对各种工程变更的全过程管理;
实现设计BOM的控制, 透过进阶产品配置实现对市场、销售的产品数据支持,;
实现对产品设计自下而上和自上而下的支持,理顺产品设计、工艺设计和制造系统的数据流程;
实现对产品、零件的编码管理系统, 以保证企业的技术数据不断得到分类累积,促进企业知识可以传递,减少知识传递的成本促进设计标准化工作建设产品设计/工艺设计的并行工作平台,提升数据的整理利用效率,并保证技术数据在企业范围内完整、统一、一致透过信息系统来保证公司的质量体系得到有效营运透过项目管理的营运达到产品开发的全程控制员工的锻炼与培养;
实现对企业研发隐形资产的管理。